5月15日,Byondis宣布收到FDA就SYD985用于治疗HER2阳性乳腺癌的生物制品许可申请(BLA)发出的完整回复函(CRL)。FDA在CRL中表示,需要更多的信息来支持审批决定
5月15日,Byondis宣布收到FDA就SYD985用于治疗HER2阳性乳腺癌的生物制品许可申请(BLA)发出的完整回复函(CRL)。FDA在CRL中表示,需要更多的信息来支持审批决定,这些信息也需要额外的时间来审查。

Byondis方对FDA的决定感到遗憾,但是也表示将继续推进SYD985在欧盟和英国的上市。SYD985的上市申请已于2022年7月获欧洲药品管理局(EMA)受理,目前该机构尚未作出审批决定。
SYD985的BLA主要是基于关键III期TULIP研究的数据。该试验是一项随机、多中心、开放标签的临床试验(n=436),比较了SYD985与医生选择的方案(physician’s choice, PC)治疗不可切除的HER2+局部晚期或转移性乳腺癌患者的疗效。研究的主要终点为无进展生存期(PFS)。
Byondis在ESMO 2021大会上公布了TULIP3研究的初步结果。结果显示,相比于PC组,SYD985组患者的PFS显著延长(7.0 vs 4.9个月;HR=0.64;P=0.002)。此外,SYD985组患者的总生存期(OS)呈改善趋势,HR为0.83(P=0.153)。
SYD985(trastuzumab duocarmazine)是Byondis利用其专有的基于duocarmazine的linker-drug技术平台ByonZine®开发的新一代HER2 ADC,由曲妥珠单抗和可切割的linker-drug缬氨酸-瓜氨酸-seco-DUocarmycin-hydroxyBenzamide-Azaindole(vc-seco-DUBA)组成。
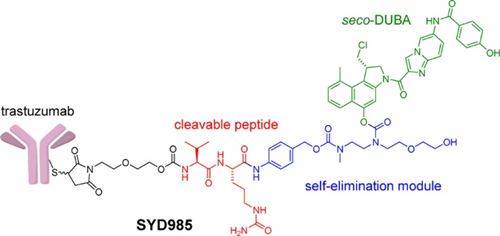
早期的ADC体内稳定性差,在到达靶向部位前就释放出细胞毒素药物,容易损伤正常组织。通过ByonZine®技术平台设计的新型ADC在血液循环中高度稳定,如果细胞毒素药物提前释放,该药物会迅速自毁,从而减少其对正常组织的损害并扩大治疗窗口。
SYD985与癌细胞表面的HER2结合后被细胞内化,随后linker在蛋白酶的作用下断裂,释放出细胞毒素药物seco-DUBA,诱导DNA损伤,最终导致肿瘤细胞死亡。
2022年5月,medac GmbH与Byondis达成合作协议,获得SYD985在欧盟、英国和其他欧洲国家(包括冰岛、列支敦士登、挪威和瑞士)的商业化权益。