该工作以年轻和老年灭活疫苗接种队列的外周免疫细胞为研究对象,通过新冠病毒抗原特异性TCR免疫组学和人工智能机器学习分析,阐明了老年人接种新冠病毒灭活疫苗后免疫功能变化的分子机制,即老年人体内抗原特异
衰老是影响新冠疫苗效果的一个关键风险因素。虽然疫苗效力的下降可以广泛地归因于免疫衰老的影响,但导致老年人疫苗应答不足的分子机制仍然知之甚少。中国于2021年7月开始对60岁以上的老年人进行全面疫苗接种。据报道,灭活病毒疫苗在18-59岁的人群中具有足够的免疫防护,同时观察到,在老年人中可以诱导中和抗体的产生。
然而,尚未有系统地评估老年人对新冠灭活病毒疫苗的综合免疫反应,特别是T细胞反应。因此,迫切需要解析老年人对疫苗免疫反应,尤其是特异性T细胞和中和抗体免疫应答不足的机制。
2023年3月14日,由暨南大学陈国兵教授、罗钧洪教授,梁晓峰教授,王鹏程副教授领衔、多单位科研团队合作于 Nature Aging 期刊发表了题为:Insufficient epitope-specific T cell clones are responsible for impaired cellular immunity to inactivated SARS-CoV-2 vaccine in older adults 的研究论文。
该工作以年轻和老年灭活疫苗接种队列的外周免疫细胞为研究对象,通过新冠病毒抗原特异性TCR免疫组学和人工智能机器学习分析,阐明了老年人接种新冠病毒灭活疫苗后免疫功能变化的分子机制,即老年人体内抗原特异性候选T细胞克隆的不足导致了老年人抗新冠病毒免疫的慢速应答。

该研究招募了121名年轻志愿者(18-30岁)和48名老年志愿者(60-85岁),分别在4个时间点收集外周静脉血:接种前、第1次接种后14天、第2次接种后7天和50天,检测中和抗体和细胞免疫水平,以评估新冠病毒灭活疫苗接种后的免疫保护作用。同时,建立了人工抗原递呈系统,全面筛选了新冠病毒野生型和包括omicron在内的13种变异株中的所有CD8 T细胞优势表位,快速制备了基于抗原表位肽的荧光标记pMHC四聚体用于标记抗原表位特异性CD8 T细胞。分选了疫苗接种前后外周血中CD4 T、CD8 T和B细胞分别进行RNA-seq,以研究不同年龄人群对疫苗接种后的免疫应答差异的分子机制。同时分选抗原特异性CD8 T细胞,进行单细胞RNA-seq和配对TCR-seq检测,建立了抗原表位特异性TCR组库。最后,通过高通量测序研究疫苗接种前后的免疫细胞受体(BCR和TCR)组库,特别是新冠病毒抗原特异性TCR组库的大小和多样性,研究年轻和年老在疫苗接种前后免疫应答差异及老年人免疫应答不足的精准机制。
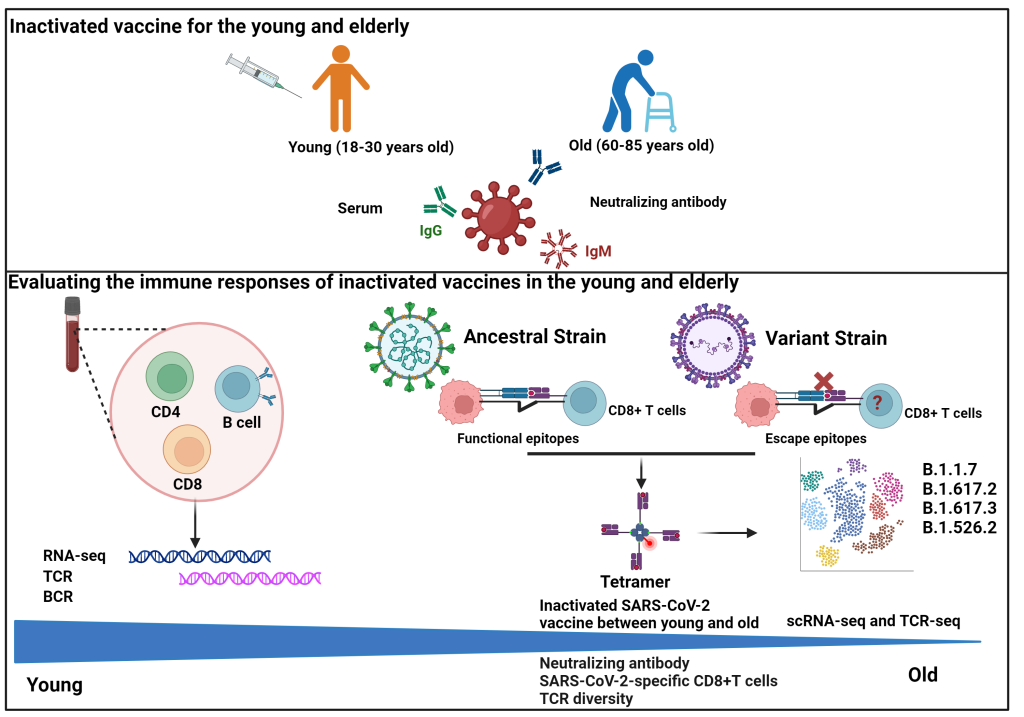
研究结果表明,121个新冠特异性CD8 T细胞抗原表位,其中13个T细胞抗原表位在变异株中突变后导致T细胞免疫反应下降。抗体方面,老年人在50天后可以达到年轻人抗体水平的67%,而细胞免疫只达到33%,且老年人疫苗接种后的细胞免疫对新冠病毒突变株的保护效率更低。
为了全面了解疫苗接种后年轻和年老受试者之间抗体产生和细胞免疫反应差异背后的潜在机制,转录组数据分析显示,抗原递呈信号减弱可能是老年人对疫苗免疫应答不佳的主要原因。免疫细胞受体组库研究发现BCR和TCR数目大小和多样性的减少导致了老年受试者疫苗接种后应答不佳。
最后研究者使用人工智能机器学习算法来评估接种前后年轻和年老供体的 CD8 TCR 库的SARS-CoV-2 表位特异性,发现新冠病毒特异性CD8 T细胞的候选克隆数目在老年受试者中明显低于年轻人,且在疫苗接种后的活化扩增能力明显低于年轻人。
总体而言,该研究是目前为止针对老年人对新冠灭活疫苗免疫应答表现及其机制研究的最全面和深入的系统研究,并且提供了直接的直观证据显示,老年人体内表位特异性T细胞候选克隆数目低下是老年人疫苗接种后表现不佳的主要原因。
该研究受科技部国家重点研发计划“主动健康与老龄化科技应对”重点专项,国家自然科学基金委,重大研究计划培育项目和广州国家实验室项目等经费支持。暨南大学博士生肖潺潺、博士后任之尧、博士生张蓓、博士生茅立鹏、广州市老年医院朱国栋教授为共同第一作者。暨南大学陈国兵教授、罗钧洪教授、梁晓峰教授,王鹏程副教授为共同通讯作者。暨南大学是论文的第一完成单位。