在一项新的研究中,研究人员发现,仅限于肺部的流感病毒感染也会导致造血干细胞的激活和血小板的形成增加。血小板可导致血栓形成。细胞因子IL-1和IL-6参与了造血干细胞激活的过程。
病毒引起的呼吸道感染可能危及生命。在一项新的研究中,来自德国保罗-埃利希研究所和海德堡大学的研究人员发现,仅限于肺部的流感病毒感染也会导致造血干细胞的激活和血小板的形成增加。血小板可导致血栓形成,这在COVID-19的严重病例中已得到证实。细胞因子IL-1和IL-6参与了造血干细胞激活的过程。相关研究结果发表在2022年10月4日的Cell Reports期刊上,论文标题为“Influenza A virus infection instructs hematopoiesis to megakaryocyte-lineage output”。
每年冬季都会有不同强度的流感爆发。它们是由流感病毒引起的。严重的流感感染病例与免疫系统脱轨、信使分子(细胞因子)过度释放引起的细胞因子风暴以及对肺细胞的损害有关。流感病毒感染可导致血管渗漏并引起血栓。这些反应与SARS-CoV-2冠状病毒引起的COVID-19严重病例相似。何时出现严重病例,发生这种情况时有哪些过程?许多细节尚不清楚。
严重流感病例的并发症包括血液中血小板数量减少和增加,这可能与血栓形成的机会增加有关。这些作者研究甲型流感病毒(H1N1)感染与血液或血小板的形成之间的关系。H1N1流感病毒是每年在德国流行的流感病毒之一。
流感病毒感染肺部及其对血液形成的影响
所有的血细胞,因此也包括所有的血小板,都是由能够产生血细胞的干细胞(造血干细胞,HSC)更新的。造血干细胞以静止状态存在于骨髓中。造血干细胞的命运在静止、自我更新和分化之间受到严格调节,以确保终身造血。
为了研究流感病毒感染对血液形成的影响,小鼠鼻内感染了流感病毒,随后对它们的造血干细胞的分化和细胞周期激活情况进行了调查。在急性流感病毒感染的头三天,血小板最初减少(血小板减少),但随后在血液中迅速上升到高于生理水平的水平(血小板增多)。这些迅速产生的血小板具有不成熟的外观(表型),并且更迅速地可被激活(高反应性)。
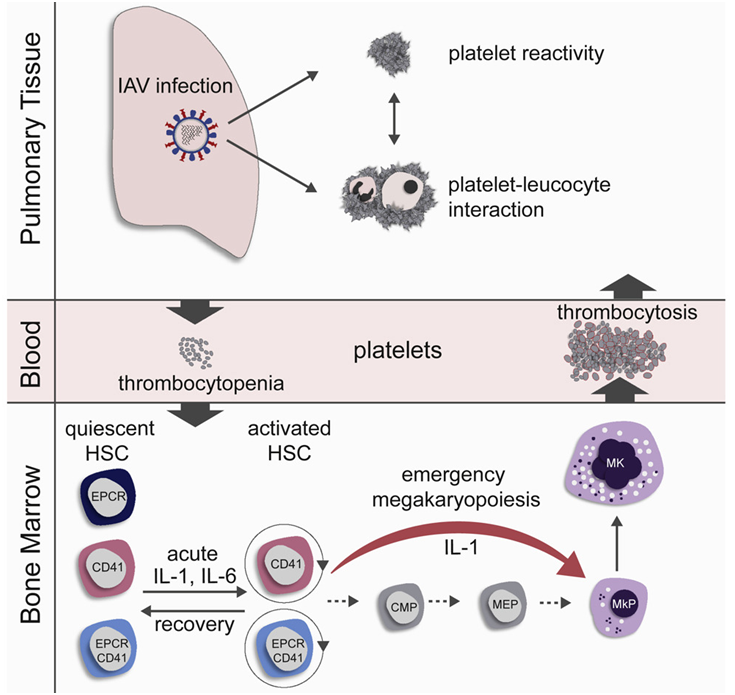
在感染后仅两天的成熟过程中发现了更多的造血干细胞(G1和S/G2/M细胞周期阶段)。造血干细胞的激活与肺部病毒滴度呈正相关,也就是说,攻击肺部的流感病毒越多,激活的造血干细胞就越多。减少流感病毒剂量的感染延迟了造血干细胞的激活,但不能阻止这种激活。在再生阶段,造血干细胞回到了静止阶段。这在接种流感疫苗的小鼠中发生的速度比其他小鼠组中快。
造血干细胞具有血小板前体细胞(platelet precursor)的典型标志物
为了澄清血小板如何能够如此迅速地产生,这些作者仔细观察了活化的造血干细胞的表型,发现造血干细胞的一个亚群已经带有血小板前体细胞---巨核细胞(megakaryocyte)---的典型标志物。具有这种表面表型的造血干细胞直接分化为巨核细胞,并产生血小板。它们跳过了之前的几个阶段。他们通过体外谱系追踪和骨髓移植证实这个造血干细胞亚群在流感病毒感染后在骨髓中迅速增殖。这些新产生的血小板比普通血小板更大,外观更不成熟,而且往往更迅速地激活,这可能导致肺部出现血栓的风险更高。
巨核细胞的快速分化过程确实已经被描述为紧急性巨核细胞生成(emergency megakaryopoiesis),这种情形发生在对系统性炎症或感染的反应中。然而,到目前为止,还没有人猜测这与局部病毒性呼吸道疾病有关。尽管小鼠的流感病毒感染仅限于呼吸道,但在受感染小鼠的骨髓中发现细胞因子IL-1和IL-6的水平增加。他们使用两组基因敲除小鼠:一组关闭了IL-1受体,另一组关闭了IL-6受体,发现这两种细胞因子在流感病毒感染期间对造血干细胞的激活和紧急性巨核细胞生成作出了决定性的贡献。
这些数据显示,即使是局部(非系统性)的病毒感染也会导致骨髓中血液形成的变化。在这个过程中形成的血小板会导致更高的血栓风险,尤其是在反应过度状态下的肺部。这可能会对流感病例产生重大影响。